
À propos de l’hATTR ou amylose familiale à transthyrétine
L’amylose familiale à transthyrétine ou hATTR est provoquée par une mutation du gène transthyrétine. Historiquement, l’hATTR était caractérisée sur la base de sa présentation clinique prédominante. Cependant, il est important d’indiquer que l’hATTR se présente souvent comme un phénotype mixte, avec certains patients principalement atteints de neuropathie (anciennement appelée polyneuropathie amyloïde familiale ou FAP), et d’autres présentant des symptômes essentiellement cardiaques (auparavant appelés cardiomyopathie amyloïde familiale ou FAC). Ces présentations cliniques sont à présent davantage décrites sous les noms respectifs d'amyloïdose hATTR avec polyneuropathie (hATTR-PN) et d'amyloïdose hATTR avec cardiomyopathie (hATTR-CM). En pratique, on observe toute une gamme de phénotypes cliniques se chevauchant dans lesquels la majorité des mutations du gène TTR conduisent à un phénotype clinique mixte avec des symptômes à la fois neurologiques et cardiologiques. Même chez des patients de la même famille, porteurs de la même mutation, la présentation clinique peut être différente.2,8,10,15
Il existe au moins 100 variantes d’amylose hATTR, chacune ayant une présentation clinique spécifique. La mutation la plus fréquente est V30M. L’affection peut se manifester par toute une série de symptômes, principalement de nature neurologique, cardiaque et/ou gastro-intestinale. La manifestation neurologique la plus caractéristique est une dégénérescence axonale longueur-dépendante, qui provoque des dysfonctions neurologiques. Les problèmes cardiaques sont principalement l’insuffisance cardiaque et les troubles de la conduction. Des troubles autonomes peuvent également se produire, par exemple des dysfonctions érectiles ou des problèmes rénaux. Les problèmes rénaux sont toutefois moins fréquents en cas d’hATTR que dans d’autres formes d’amylose. 2,8,10,15
L’amylose hATTR est une maladie rare. On ne sait pas exactement combien de personnes en souffrent, mais on estime qu’il y en aurait 50 000 dans le monde.16
L'amyloïdose hATTR avec polyneuropathie (hATTR-PN) est assez fréquente dans certains pays comme le Portugal, la Suède, Chypre, Majorque et le Japon. Dans le nord du Portugal par exemple, on estime même que 1 personne sur 538 est atteinte de la maladie.7,8
L'amyloïdose hATTR avec cardiomyopathie (hATTR-CM) est plus courante parmi la population Afro-Américaine.26
L’amylose hATTR est une affection autosomique dominante évolutive et irréversible. Si l’un des deux partenaires possède un gène muté, les enfants auront alors 50 % de risque d’également développer la maladie. C’est pourquoi la maladie est aujourd’hui relativement concentrée dans certaines régions. Cependant, la tendance actuelle à la migration devrait obliger les médecins à la vigilance et une anamnèse familiale approfondie n’est certainement pas un luxe superflu pour établir le diagnostic. Vu le caractère évolutif irréversible de l’affection, un diagnostic précoce est extrêmement important pour pouvoir espérer stabiliser quelque peu la maladie. Mais les très nombreux symptômes sont généralement responsables du renvoi d’un médecin à un autre, ce qui peut parfois durer plusieurs années, entraînant des erreurs au niveau du diagnostic et des traitements. Cela peut avoir des conséquences importantes puisque l’âge médian du patient au moment du diagnostic est de 63 ans et son espérance de vie est de 2 à 15 ans dès l’apparition des symptômes.17,18
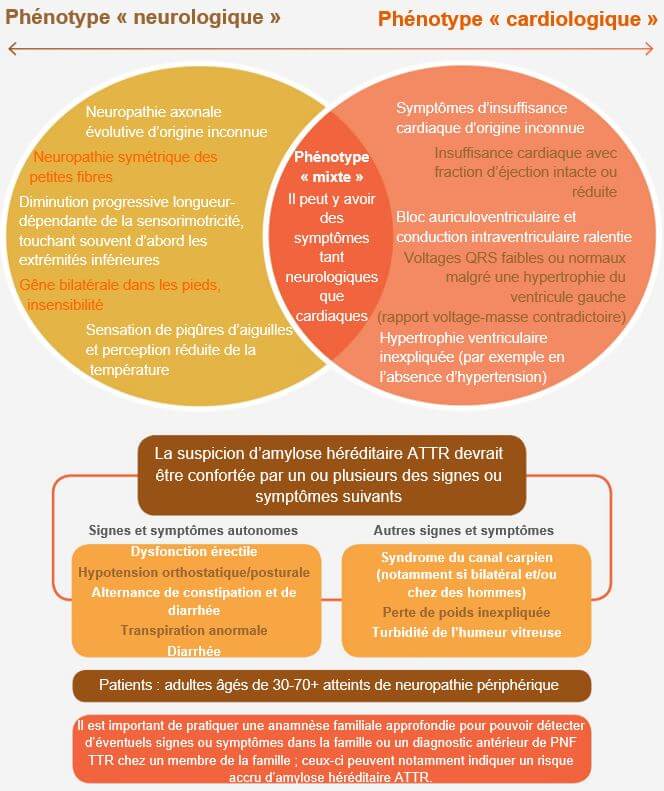
Selon les symptômes qui se manifestent, on distingue deux principaux phénotypes de l’hATTR
- Si les symptômes sont cardiaques, on parle d'amyloïdose hATTR avec cardiomyopathie (hATTR-CM)
- Si les symptômes sont ceux d'une neuropathie à dysfonctions sensorimotrices on parle d'amyloïdose hATTR avec polyneuropathie (hATTR-PN).
Le phénotype peut également être mixte. Cette multitude de phénotypes s’explique par les différentes mutations génétiques possibles du gène TTR. La forme la plus décrite est la mutation V30M, dans laquelle la valine est remplacée par la méthionine en position 30 de la protéine transthyrétine.8
Des symptômes autonomesse développent généralement dans les premiers stades de la maladie, avant l’apparition d’une déficience motrice ou d’une atteinte globale de la qualité de vie du patient.18 Ces symptômes peuvent cependant varier en fonction du type de mutation. Les troubles autonomes précoces sont surtout : constipation réfractaire, alternance de constipation et de diarrhée ou diarrhée uniquement, anorexie et perte de poids, nausées et troubles de l’érection. À un stade ultérieur, le patient développe également d’autres troubles autonomes tels que des problèmes urinaires (difficulté à uriner, rétention ou incontinence urinaire) et hypotension orthostatique.8
Si un de vos patients présente certains symptômes neurologiques et/ou cardiaques, qui peuvent également s’accompagner de symptômes autonomes ou autres, ayez certainement à l’esprit l’amylose hATTR et orientez ce patient vers un centre de référence universitaire reconnu.
La figure ci-dessous vous aidera à identifier les symptômes à prendre en compte les plus courants.
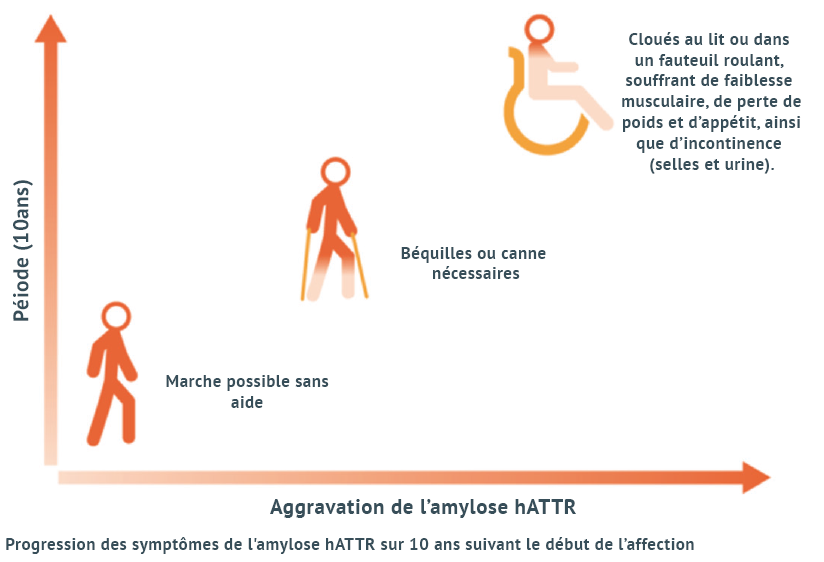
Dans le cas de l’ATTR à dysfonctions sensorimotrices (ATTR-PN), une fois que les symptômes se manifestent, l’espérance de vie sans intervention est de 7 à 12 ans.8 Chez les personnes qui développent la maladie à un âge précoce, les symptômes évoluent en général plus rapidement que lorsque la maladie débute à un âge plus avancé. Si l’amylose hATTR ne commence qu’après l’âge de 55 à 60 ans, l’espérance de vie sera d’environ 20 ans.2
Les dysfonctions sensorimotrices se manifestent en premier lieu généralement dans les membres distaux, qui sont douloureux ou insensibles. La sensibilité à la température diminue et les patients parlent d’une sensation permanente de « piqûres d’aiguilles » dans les pieds. À ce stade précoce, la proprioception, la force musculaire et les réflexes tendineux sont encore normaux.8,10
Quelques mois après le début des premiers symptômes, la perte sensorielle finit par s’étendre au-dessus du niveau de la cheville. Lorsque les plus grandes fibres nerveuses et sensorielles sont touchées, le patient perçoit beaucoup plus la neuropathie. La marche régresse à vue d’œil et les patients perdent leur capacité à garder l’équilibre.8,10
Au fil des mois et des années, la perte de la fonction sensorielle s’étend en direction proximale jusqu’à la cuisse, puis aux membres supérieurs. Il devient de plus en plus difficile de marcher sans aide jusqu’au moment où le patient finit en fauteuil roulant.8,10
Au cours des dernières années, les patients souffrent en permanence de diarrhée ou d’incontinence fécale et finissent par être atteints de malnutrition sévère. Avec l’aggravation de la neuropathie, les patients finissent par mourir d’infections secondaires, de cachexie (malnutrition extrême) ou de mort subite.8,10
Il n’est toutefois pas absolument indispensable que la neuropathie débute au niveau des membres inférieurs. Elle peut tout aussi bien se manifester dans les pieds que dans les mains. Chez certains patients, paresthésie et douleur dans un poignet ou les deux sont une première caractéristique (syndrome du canal carpien).
Le spectre clinique des symptômes cardiaques est assez large8,23,25 :
- Essoufflement
- Hypotension orthostatique
- Hypertrophie biventriculaire (épaisseur de la paroi > 12 mm)
- Pseudo-infarctus
Il va donc sans dire qu’il n’est pas facile, ici non plus, d’établir le bon diagnostic uniquement à partir des symptômes cardiaques. C’est pourquoi il est certainement utile d’également voir du côté d’éventuelles neuropathies, mais n’oubliez pas que les symptômes cardiaques peuvent également se manifester seuls en cas d’amylose hATTR, sans composante neurologique !
Certains symptômes gastro-intestinaux peuvent également être indicatifs d’une hATTR. Énumérons-les brièvement8,9,11,25 :
- Alternance de constipation et de diarrhée
- Nausées et vomissements
- Satiété précoce
- Perte de poids non voulue et malnutrition (diminution de l’IMCm*)
- Gastroparésie
- Incontinence fécale (en général seulement au cours d’une phase ultérieure de l’affection)
*L’IMCm est calculé en multipliant l’IMC (kg/m2) par le taux d’albumine sérique (g/l) afin de compenser l’œdème.
Les autres symptômes auxquels un patient hATTR peut être confronté sont les suivants8,25 :
- Dyshidrose (petites vésicules à paroi mince, pleines de liquide, sur les mains et les pieds)
- Dysfonction érectile
- Hypotension orthostatique
- Rétention urinaire
- Incontinence urinaire
- Troubles de la vue (notamment turbidité de l’humeur vitreuse ou glaucome)
PHÉNOTYPES DE L’AMYLOSE hATTR
RÉCAPITULATIF : LES PRINCIPAUX INDICATEURS D’ALERTE
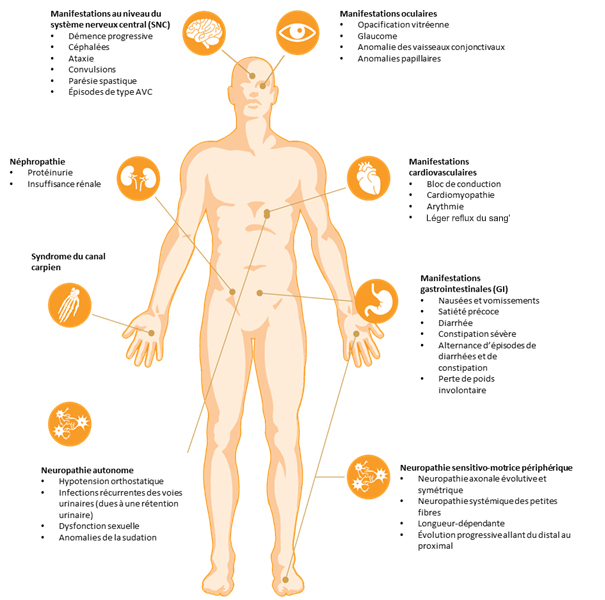
La figure ci-dessous récapitule tous les symptômes. Il faut souligner que plusieurs symptômes apparaissent généralement en même temps. Une anamnèse approfondie, même en dehors de votre discipline professionnelle, est donc tout à fait indispensable. Notez bien qu’il peut également y avoir une certaine hétérogénéité des symptômes.
Vu le large éventail de symptômes possibles, il n’est pas rare d’établir un diagnostic incorrect au début des symptômes d’un patient. Les symptômes neuropathiques sont analogues à certaines autres affections telles que par exemple la polyneuropathie inflammatoire démyélinisante chronique (PIDC). Il s’agit ici aussi de symptômes d’aréflexie diffuse, d’augmentation du liquide céphalorachidien (LCR) et de certaines autres caractéristiques électromyographiques. Une diminution de la vitesse de conduction nerveuse, ainsi qu’une augmentation de la teneur en protéines dans le LCR peuvent se manifester tant dans la PIDC que dans l’hATTR, ce qui rend leur différenciation très difficile. Si un traitement intraveineux par immunoglobuline n’apporte pas d’amélioration et qu’au contraire la neuropathie s’intensifie, cela peut indiquer qu’une PIDC n’est pas à l’origine des symptômes neuropathiques.12,13
D’autres affections présentent également des symptômes neuropathiques similaires, par exemple la neuropathie diabétique et alcoolique, la maladie de Charcot-Marie-Tooth et l’amylose à chaîne légère.12,27
Sur le plan cardiologique également, un diagnostic erroné n’est pas impensable. Il faut exclure l’hATTR chez les patients atteints de cardiomyopathie hypertrophique à hémochromatose, de la maladie de Fabry et de sarcoïdose cardiaque.28
En cas de progression axonale de la neuropathie et/ou de symptômes cardiaques tels qu’une insuffisance cardiaque ou des troubles de la conduction, gardez aussi à l’esprit l’hATTR, surtout lorsque des symptômes autonomes ou des dysfonctions érectiles se manifestent également
COMMENT DIAGNOSTIQUER L’hATTR AVEC CERTITUDE ?
Dès que vous avez une suspicion d’hATTR suite à une anamnèse approfondie du patient et de sa famille, vous pouvez poser le diagnostic avec certitude en recherchant une mutation TTR au moyen d’une analyse ADN. De plus, une biopsie tissulaire (nerf, ponction de graisse sous-cutanée par aspiration ou autres tissus atteints) avec coloration au rouge Congo permet de mettre en évidence des dépôts d’amyloïde. Une coloration au rouge Congo donnant une image vert pomme à la lumière polarisée est indicative d’amyloïde.10,23
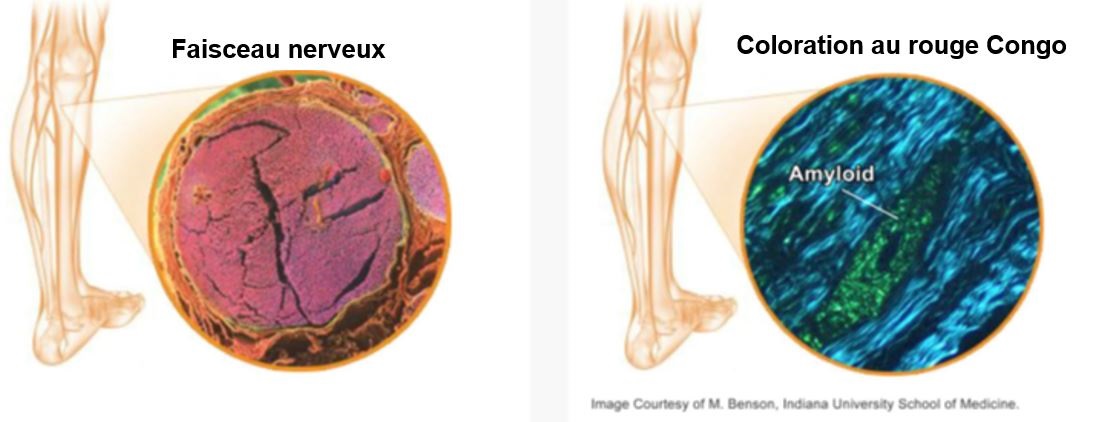
Coloration au rouge Congo d'un prélèvement
Le neurologue, mais aussi le cardiologue ont un rôle primordial dans le suivi de l’amylose hATTR. Et si ce sont surtout des symptômes neurologiques qui apparaissent à l’avant-plan, il est malgré tout important de suivre la fonction cardiaque de manière adéquate.
L’amylose cardiaque peut typiquement être caractérisée par de bas voltages QRS et un pseudo-infarctus avec modification des ondes Q ou T sur l’électrocardiogramme (ECG). La présence de bas voltages QRS associée à un épaississement biventriculaire (avec une épaisseur du ventricule gauche > 12 mm, et souvent ≥ 15 mm) visible par échocardiographie permet également d’envisager une amylose cardiaque.19,20
L’imagerie cardiaque par résonance magnétique (IRMc) est plus chère que l’échocardiographie et apporte des informations structurelles comparables. Cependant, elle a l’avantage d’être plus reproductible et de donner des informations plus précises. Elle permet également une meilleure quantification du volume ventriculaire, de l’épaisseur et de la masse de la paroi. 19
La scintigraphie myocardique permet le diagnostic différentiel entre l’ATTR-CM et l’AL ou les autres maladies hypertrophiques. Des traceurs isotopiques tels que le 99mTc-PYP (pyrophosphate) ou le 99mTc-DPD (acide 3,3-diphosphono-1,2-propanodicarboxylique) ou 99m Tc-HMDP (hydroxyméthylène diphosphonate) sont injectés chez les patients et se lient aux dépôts d’ATTR (ATTRwt et hATTR) dans tout l’organisme. Un signal fort de traceur dans le cœur indique une ATTR-CM due aux dépôts amyloïdes de TTR.20,22,23
Un diagnostic précoce d’amylose cardiaque est important pour éviter des lésions irréversibles au cœur. Chez les patients atteints d’amylose cardiaque, les dépôts d’amyloïde dans le cœur peuvent se trouver à différents endroits, notamment dans les oreillettes, les ventricules et l’espace périvasculaire. Il arrive parfois aussi que les valves cardiaques et le système de conduction soient affectés. L’amylose cardiaque entraîne donc une augmentation progressive de l’épaisseur du myocarde ventriculaire gauche et droit, du septum interatrial et des valves auriculoventriculaires.23
Il va sans dire que vu le large éventail de symptômes possibles, une approche multidisciplinaire de cette pathologie est le seul bon choix. Dans un premier temps, le traitement doit être axé sur la prévention de la production et du dépôt de fibrilles amyloïdes. Jusqu’à il y a quelques années, seule une greffe hépatique à haut risque pouvait être envisagée. Mais ces dernières décennies des alternatives médicamenteuses ont vu le jour comme traitement de l’hATTR chez des patients adultes atteints de polyneuropathie (hATTR-PN)2,10 comme : Tafamidis - Patisiran - Vutrisiran.
*Pour plus d’informations relatives à la sécurité d'emploi du médicament, veuillez consulter le résumé des caractéristiques du produit (SmPC)
Outre ces solutions médicamenteuses, les différents symptômes doivent bien entendu être traités, notamment avec des antidouleurs, des antidiarrhéiques, des traitements contre l’hypotension orthostatique et des diurétiques ou des antagonistes de l’aldostérone en cas d’insuffisance cardiaque. Un pacemaker peut s’avérer nécessaire en cas de troubles de la conduction. Dans le traitement de l’amylose cardiaque, il est important d’éviter d’utiliser des bêtabloquants et des inhibiteurs calciques; ces derniers peuvent en effet aggraver l’hypotension et diminuer la contractilité myocardique en raison de leur effet inotrope négatif. Les inhibiteurs de l’ECA et les sartans doivent également être administrés avec prudence vu qu’ils peuvent aussi aggraver l’hypotension.10




